Belajar Hukum Boyle – Sebagaimana telah dipahami bahwa gas bersifat menempati ruang, bergerak secara acak, dapat dimampatkan, memiliki tekanan, dan mudah berdifusi. Karena itu, gas memiliki besaran makroskopik seperti volume, tekanan, dan suhu yang dapat diukur di laboratorium.
Selain itu, gas juga memiliki besaran mikroskopik seperti kecepatan molekul, momentum molekul, dan energi kinetik molekul. Berbeda dengan besaran makroskopik, besaran mikroskopik tidak dapat diukur di laboratorium namun dapat dihitung. Besaran-besaran tersebut dapat dihubungkan oleh massa dan kerapatan gas.
Hubungan inilah yang menjadi kajian para ilmuwan seperti Robert Boyle, Jacques Charles, dan Joseph Gay-Lussac. Mereka merumuskan hukum-hukum gas yang kelak diberi nama sesuai dengan nama mereka sebagai bentuk penghargaan.
[ez-toc]
Bunyi Hukum Boyle
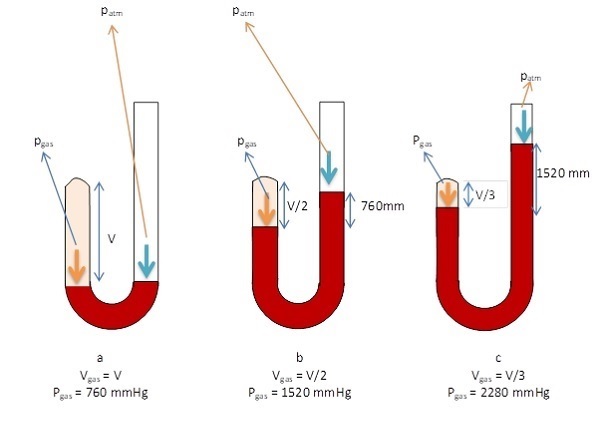
Telah disebutkan sebelumnya bahwa para ilmuwan sangat tertarik pada hubungan antara besaran makroskopik dan mikroskopik yang menentukan keadaan suatu gas, baik dalam ruang terbuka maupun tertutup. Apabila gas yang diamati berada dalam ruang tertutup, maka besaran-besaran yang menentukan keadaan gas adalah tekanan (p), volume (V), dan suhu gas (T). Hubungan inilah yang dikaji secara mendalam oleh Robert Boyle . Melalui serangkaian percobaan atau eksperimen, Boyle pada akhirnya merumuskan hukum Boyle pada tahun 1662.
Dalam eksperimennya sebagaimana ditunjukkan gambar di atas, Boyle menggunakan bejana berbentuk J. Eksperimen dimulai dengan kondisi yang ditunjukkan gambar (a) yakni tekanan gas berada pada 1 atm atau sama dengan 760 mmHg dan volume sebesar V (ketinggian merkuri pada lengan bejana pertama yang tertutup dan lengan bejana kedua yang terbuka adalah sama).
Pada gambar (b), sejumlah merkuri ditambahkan melalui mulut bejana yang terbuka untuk memberikan perbedaan ketinggian 760 mmHg antara kedua lengan bejana. Pada kondisi ini, tekanan gas sebesar 1520 mmHg yang diperoleh dari tekanan gas sebesar 760 mmHg ditambah dengan tekanan atmosfer sebesar 760 mmHg, adapun volume adalah V/2.
Pada gambar (c), jika tekanan kembali ditambah sebesar 760 mmHg melalui mulut bejana yang terbuka, maka terjadi peningkatan tekanan pada gas sehingga tekanan total gas menjadi 2280 mmHg dan volume gas berkurang ke V/3.
Hasil eksperimen menunjukkan bahwa bila suhu gas yang berada dalam bejana tertutup dipertahankan konstan, maka tekanan gas berbanding terbalik dengan volumenya. Dengan kata lain, apabila tekanan diperbesar maka volume akan berkurang. Sebaliknya, jika volume gas diperbesar maka tekanan gas akan mengecil.
Dengan demikian bunyi hukum Boyle adalah sebagai berikut.
“Pada suhu tetap, volume gas berbanding terbalik dengan tekanannya.”
Hukum Boyle berlaku untuk hampir semua gas dengan kerapatan rendah. Namun perlu dipahami pula bahwa hukum Boyle ini hanya berlaku dalam kondisi tertentu seperti suhu gas tetap, gas berada dalam ruang tertutup, tidak terjadi reaksi kimia, dan tidak terjadi perubahan wujud gas. Beberapa contoh penerapan hukum Boyle dalam kehidupan sehari-hari antara lain manometer, pipa siphon, pipet, dan pompa air.
Rumus Hukum Boyle

Dari berbagai eksperimen yang telah dilakukan, Boyle kemudian mengembangkan sebuah persamaan yang menggambarkan hubungan antara tekanan dan volume gas dalam ruang tertutup dan bersuhu tetap.
Persamaan ini didasarkan pada hukum Boyle yang menyatakan bahwa pada suhu tetap, volume gas berbanding terbalik dengan tekanannya. Atau dengan kata lain, pada gas ideal, hasil kali tekanan gas dengan volume suatu gas dalam ruangan tertutup adalah tetap, dengan syarat suhu gas tidak berubah.
Dari persamaan di atas, dapat dikatakan bahwa selama proses berlangsung, jumlah energi yang sama yang diberikan kepada sistem akan tetap ada selama suhu dipertahankan konstan atau tetap. Karena itulah, secara teori, nilai k akan tetap konstan.
Jika tekanan gas berubah dari tekanan gas pertama (p₁) menjadi tekanan gas kedua (p₂) pada suhu konstan, maka akan diperoleh persamaan sebagai berikut.

Jika divisualisasikan dalam bentuk grafik, maka akan menghasilkan sebuah kurva yang disebut kurva isothermal yakni kurva yang bersuhu sama.
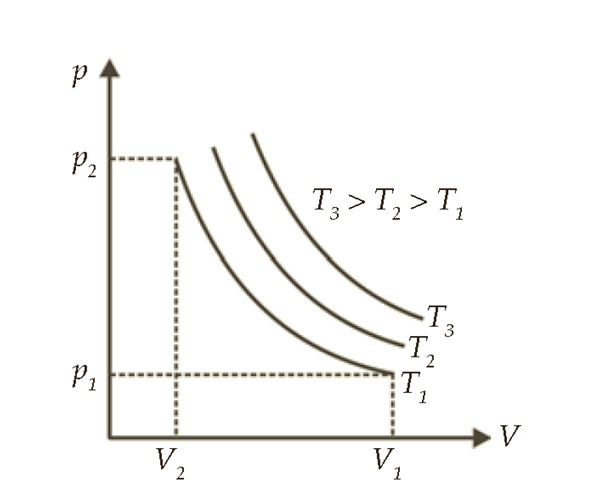
Dari grafik terlihat bahwa semakin kecil tekanan gas maka voume menjadi semakin besar namun hasil kali tekanan dan volume gas tetap konstan.
Contoh Soal Hukum Boyle dan Jawabannya
Berikut disajikan beberapa contoh soal tentang Hukum Boyle disertai dengan pembahasannya.
1. Contoh soal 1
Ruang tertutup yang volumenya 0,2 m³ berisi gas dengan tekanan 60.000 Pa. Hitunglah volume gas jika tekananya dijadikan 80.000 Pa.
Pembahasan :
Diketahui :
p₁ = 60.000 Pa
V₁ = 0,2 m³
P₂ = 80.000 Pa
Ditanya : V₂ = … ?
Jawab : p₁ V₁ = p₂ V₂
V₂ = p₁ V₁ ÷ p₂
V₂ = 60.000 × 0,2 ÷ 80.000
V₂ = 1,2 ÷ 80.000
V₂ = 0,15 m³
Jadi, volume gas sekarang adalah 0,15 m³.
2. Contoh soal 2 – UN 2011/2012
Sejumlah gas ideal menjalani proses isotermik, sehingga tekanan menjadi 2 kali tekanan semula, maka volumenya menjadi …
A. 4 kali semula
B. 2 kali semula
C. 0,5 kali semula
D. 0,25 kali semula
E. Tetap
Jawaban : C
Pembahasan :
Diketahui :
- Tekanan gas mula-mula, p₁ = p
- Tekanan gas akhir, P₂ = 2p
- Proses isotermis, T₁ = T₂ = T₃
Ditanya : Volume akhir gas
Jawab : Volume akhir gas dapat diperoleh dari hukum Boyle yaitu sebagai berikut.
p₁ V₁ = p₂ V₂
p₁ V₁ = 2p₁ V₂
V₂ = p₁ V₁ ÷ 2p₁
V₂ = V₁ ÷ 2
V₂ = ½ V₁
Jadi, volume gas akhir adalah 0,5 kali volume gas mula-mula.
3. Contoh soal 3 – PPI 1979
Pada hukum Boyle, p.V = k, k mempunyai dimensi …
A. Daya
B. Usaha
C. Momentum linier
D. Suhu
E. Konstanta pegas
Jawaban : B
Pembahasan :
Diketahui : V.p = k
Ditanya : k = …?
Jawab :
p.V = k
k = p.V = (m³)
k = Nm = Joule
Joule adalah satuan usaha. Jadi, k mempunyai dimensi usaha.
4. Contoh soal 4
Perhatikan gambar berikut!
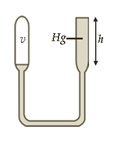
Berdasarkan eksperimen hukum Boyle diperoleh data sebagai berikut; ketika h = 50 mm, V = 18 cm³ dan ketika h = 150 mm, V = 16 cm³. Hitunglah besar tekanan udara luar dalam (mmHg).
Pembahasan :
Diketahui :
h₁ = 50 mm
V₁ = 18 cm³
h₂ = 150 mm
V₂ = 16 cm³
Ditanya : Tekanan udara luar
Jawab :
Untuk menjawab soal ini, kita menggunakan konsep bejana berhubungan. Karena itu, tekanan gas dalam V adalah sebagai berikut.
Keadaan 1 :
p₁ = (p₀ + h₁) mmHg
p₁ = (p₀ + 50) mmHg … (a)
Keadaan 2 :
p₂ = (p₀ + h₂) mmHg
p₂ = (p₀ + 150) mmHg … (b)
Menurut hukum Boyle,
p₁ V₁ = p₂ V₂
p₂ = V₁/V₂ × p₁
p₂ = 18/16 × p₁ … (c)
Kemudian, subtitusikan persamaan (c) ke persamaan (b), sehingga diperoleh :
p₂ = (p₀ + 150) mmHg
18/16 × p₁ = p₀ + 150
p₁ = 16/18 (p₀ + 150) … (d)
Langkah selanjutnya adalah subtitusikan persamaan (d) ke persamaan (a), sehingga diperoleh :
p₁ = (p₀ + 50) mmHg
16/18 (p₀ + 150) = p₀ + 50
16 (p₀ + 150) = 18 (p₀ + 50)
16p₀ + 2400 = 18p₀ + 900
2400 – 900 = 18p₀ – 16p₀
1500 = 2 p₀
p₀ = 1500 ÷ 2
p₀ = 750
Jadi, tekanan udara luar adalah 750 mmHg atau 75 cmHg.
5. Contoh soal 5
Di antara hal-hal berikut, yang bukan merupakan syarat terjadinya hukum Boyle adalah …
A. Suhu tetap
B. Volume dan tekanan tetap
C. Tidak terjadi reaksi kimia
D. Gas di ruang tertutup
E. Wujud gas tidak berubah
Jawaban : B
Pembahasan :
Hukum Boyle hanya berlaku dalam kondisi tertentu seperti suhu gas tetap, gas berada dalam ruang tertutup, tidak terjadi reaksi kimia, dan tidak terjadi perubahan wujud gas.
Sekian pembahasan kita kali ini mengenai hukum Boyle terkait dengan bunyi dan rumus hukum Boyle yang disertai dengan contoh soal dan pembahasannya.
Editor: Muchammad Zakaria
Download berbagai jenis aplikasi terbaru, mulai dari aplikasi windows, android, driver dan sistem operasi secara gratis hanya di Nesabamedia.com:













